Лечение миодистрофия дюшена. Тяжелая генетическая миодистрофия дюшенна. Поражение мускулатуры скелета
Мышечная дистрофия Дюшенна
Пенни Саусол, мама Дэна Хансона
«У моего сына Дэна диагностировали мышечную дистрофию Дюшенна в возрасте трех лет. По себе знаю, каким сокрушительным ударом может быть такой диагноз.
«Так же, как и мы, Вы, должно быть, пытаетесь понять, как вообще можно примириться с этим. Мы нашли свой способ справиться, и у Вас получится. Я говорила себе, что он – все тот же человек, но я увидела его с другой стороны. Эта мысль помогала мне идти вперед. Если ему хорошо, то и мне будет тоже.
«Узнав о диагнозе Дэна, я первым делом начала искать исследования о том, какую жизнь ведут люди с мышечной дистрофией Дюшенна. Я узнала, что он может жить такой же полноценной и счастливой жизнью, как любой другой человек. В тот момент, это стало для меня большим утешением, а, спустя годы, я в этом была уже убеждена.
«У Дэна есть близкие друзья, он хорошо учится, занимается спортом и с уверенностью смотрит в будущее. Сейчас столько помощи и поддержки оказывается людям с ограниченными возможностями. Они могут пробовать себя в спорте и получить необходимое образование.
«Я спросила моего сына, которому сейчас 15, что бы он хотел сказать семьям, которые получили известие о таком диагнозе. Он ответил, «Сначала это кажется ужасным, но потом станет лучше».
Что такое мышечная дистрофия Дюшенна?
Мышечная дистрофия Дюшенна – это мышечная атрофия, вызванная недостатком белка под названием дистрофин . Обычно этой болезни подвержены только мальчики. Около 100 мальчиков с мышечной дистрофией Дюшенна рождаются в Соединенном Королевстве каждый год, и на данный момент на территории Королевстве зарегистрировано 2500 мальчиков и молодых людей с мышечной дистрофией Дюшенна. Возможен риск, что из 3500-5000 младенцев мужского рода один будет с мышечной дистрофией Дюшенна.
Мышечная дистрофия Дюшенна – это серьезное заболевание, которое вызывает прогрессирующее ослабление мышц. Из-за нехватки дистрофина мышечные волокна ослабевают и уступают место волокнистой или жировой ткани, вызывая постепенное разрушение мышц.
Каковы причины мышечной дистрофии Дюшенна?
Мышечная дистрофия Дюшенна – это генетическое заболевание, вызванное отклонением или мутацией в генетическом коде (ДНК). При мышечной дистрофии Дюшенна мутация возникает в гене, который называется дистрофин и который расположен в Х-хромосоме или половой хромосоме (у девочек две Х-хромосомы, у мальчиков – только одна). В половине случаев заболевание передается от матери, являющейся «носителем», но оно также может стать результатом новой мутации в генах ребенка.
Если мутация происходит в организме женщины, то она называется «носителем». Обычно носители женского пола не подвержены этому заболеванию, поскольку у них есть вторая Х-хромосома, где дистрофин может вырабатываться. У небольшого количества женщин есть некоторая степень мышечной слабости, их называют «явными носителями».
У каждого сына носителя есть риск 50%, что он будет подвержен этому заболеванию, а у каждой дочери – риск 50%, что она – носитель.
Консультация генетиков и обследование остальных членов семьи на риск быть носителями должны быть проведены как можно скорее, как только мальчику будет поставлен диагноз мышечной дистрофии Дюшенна. Вы можете обратиться к Вашему врачу-консультанту или семейному врачу.
Как распознают мышечную дистрофию Дюшенна?
У большинства мальчиков с мышечной дистрофией Дюшенна это заболевание не обнаруживают, пока не появятся соответствующие симптомы, за исключением тех случаев, когда в семье есть человек с таким заболеванием. Первые признаки мышечной дистрофией Дюшенна обычно появляются в возрасте от одного до трех лет и, как правило, связаны с нарушением функционирования мышц. Мальчики могут начать ходить позже, чем их сверстники, падать чаще или испытывать трудности с бегом, прыжками или подъемом. У них могут быть увеличены икроножные мышцы.
У некоторых мальчиков с мышечной дистрофией Дюшенна замедленная речь, что может стать первым признаком этого заболевания. При сдаче анализа крови обнаруживается высокое содержание белка под названием креатинкиназа (КК). КК, как правило, появляется в мышце, но при их повреждении, как в случае с мышечной дистрофией Дюшенна, он попадает в кровь. Ферменты печени (аминотрансферазы, ALT и AST) также часто находятся на высоком уровне , как следствие повреждения мышц, а не нарушений печени.
Мышечная дистрофия Дюшенна должна быть подтверждена генетическим анализом крови . Разные типы генетических анализов предоставляют специфические и подробные данные о мутации ДНК.
Генетическое подтверждение заболевание имеет решающее значение. Это позволяет семьям проводить пренатальную диагностику будущих беременностей, а также обследовать остальных членов семьи на случай, если они являются носителями мутации в гене дистрофина. Более того, генетическая диагностика поможет определить, может ли мальчик претендовать на участие в клиническом исследовании, которое начинается или запланировано.
Ваш врач также может посоветовать пункционную биопсию мышц , когда берут небольшой образец мышцы для анализа. Такие исследования могут предоставить информацию о том, какое количество белка дистрофина присутствует в клетках мышцы, а также в некоторых случаях помочь отличить мышечную дистрофию Дюшенна от слабой формы заболевания, известной как мышечная дистрофия Беккера. Однако, как правило, достаточно клинических признаков и генетического анализа, чтобы различить эти две формы, без необходимости мышечной биопсии.
Существует ли лечение или лекарство?
Пока не было изобретено лекарства для этого заболевания, но есть обнадеживающие исследования в этой области. Подход с привлечением множества различных специалистов, в том числе физиотерапевтов и специалистов по трудотерапии (occupational therapists – специалисты, помогающие людям с ограниченными возможностями освоиться в жизни ) – это лучший способ контроля мышечной дистрофии Дюшенна.
Иметь доступ к специалистам из разных областей – жизненно важно для обеспечения человека с мышечной дистрофией Дюшенна всей необходимой комплексной поддержкой. Это означает, что у пациента должна быть возможность за одно посещение специализированного центра проконсультироваться у специалистов разных направлений: получить консультации по дыхательной системе, кардиосистеме и физиотерапии. Работая вместе, такие специалисты обеспечат более эффективный уход.
Важно регулярно проверяться у специалистов, чтобы принимать решения о новых методах лечения в самое подходящее время, и возможно, предвидеть и предотвращать нарушения. Рекомендуется посещать Вашего лечащего врача раз в шесть месяцев, а физиотерапевта – каждые три-четыре месяца.
Стероиды (преднизон или дефлазакорт ) часто назначаются при мышечной дистрофии Дюшенна, так как они замедляют на какое-то время процесс ослабевания мышц и нарушения подвижности и предотвращают или откладывают развитие осложнений. Однако есть множество возможных побочных эффектов, которые необходимо тщательно контролировать.
Начали появляться другие лекарства для мышечной дистрофии Дюшенна, включая Трансларну (аталурен), которая на данный момент доступна в некоторых европейских странах и способна замедлить развитие симптомов у мальчиков с мышечной дистрофией Дюшенна. Трансларна действуют только на небольшую группу мальчиков, которые являются носителями определенной мутации в гене дистрофина («нонсенс» мутация , где точечная мутация в последовательности ДНК приводит к появлению стоп-кодона). Ваш лечащий врач сообщит Вам, будет ли это лекарство эффективным для Вашего сына. В скором времени могут быть одобрены и другие средства для определённых мутаций.
Продолжается интенсивное изучение возможного лечения мышечной дистрофии Дюшенна. Некоторые лекарства сейчас проходят клинические испытания.
Полезно иметь копию генетического отчета (с типом и расположением мутации в гене дистрофина, обнаруженной у Вашего ребенка). Это поможет определить, какое лекарство или испытание больше подходит для Вашего ребенка.
Реестр мышечной дистрофии Дюшенна предоставит свежую информацию о ходе клинических испытаний и может помочь определить, какие дети предположительно могут быть допущены к конкретным клиническим исследованиям. Ваши врачи расскажут Вам как зарегистрировать Вашего ребенка в этом реестре.
The North Star Adult Network, в которую входят эксперты-консультанты по нервно-мышечным заболеваниям, специалисты смежных профессий, сами пациенты, живущие с мышечной дистрофией Дюшенна, и организация Muscular Dystrophy UK, работает над улучшением стандартных методов ухода и поддержки для взрослых на территории Соединенного Королевства. Есть и педиатрическая версия – the North Star Project – которая работает над улучшением ухода за детьми с мышечной дистрофией Дюшенна.
Если Вы хотите узнать больше о последних исследованиях команды, свяжитесь с научно-исследовательским отделом по телефону: 020 7803 4813 или по почте: [email protected] .
Какой прогноз?
На ранних стадиях у мальчиков с мышечной дистрофией Дюшенна обнаруживаются признаки мышечной слабости, такие как: трудности при беге, прыжках, подъеме по лестнице или с пола. Они могут двигаться в манере Гауэра (необходимость поддерживать себя руками за бедра при подъеме с пола) и ходить вразвалку (на носочках и с изогнутой поясницей).
По мере развития мышечной слабости мальчикам становится сложнее ходить так же быстро или так же далеко, как другим детям, они могут начать падать. Они все еще могут подниматься по лестнице, но уже приставляя вторую ногу к первой.
Позже, когда ходьба будет даваться с большим трудом, мальчикам будет сложно подниматься по лестнице или вставать с пола.
Стероиды значительно меняют ход болезни. Они помогают восстановить мышечную силу на какой-то определенный период времени и откладывают тот момент, когда мальчикам может понадобиться инвалидное кресло.
Спрогнозировать, когда пациент начнет пользоваться инвалидным креслом, – сложно, поскольку каждый случай отличается один от другого.
Тем не менее, потребность в инвалидном кресле обычно возникает в возрасте 8-11 лет (иногда раньше, иногда позже). Сначала оно будет нужно только для длинных дистанций. Позднее кресло будет использоваться постоянно. На этом этапе у мальчиков могут возникнуть трудности с поднятием рук выше плеч.
С дальнейшим развитием мышечной слабости сложнее становится сохранять положение тела, могут возникнуть осложнения. Заболевание – серьезное и может сократить продолжительность жизни, но в настоящее время, с высокими стандартами медицинской помощи, большинство юношей с мышечной дистрофией достигают взрослой жизни.
У некоторых мальчиков с мышечной дистрофией Дюшенна могут появиться трудности с обучаемостью и/или поведением, что является результатом воздействия заболевания на мозг. Проблемы с обучением при мышечной дистрофии Дюшенна не прогрессируют, важно их сразу распознать и сообщить о них (например, в школу), чтобы обеспечить ребенка поддержкой, которая необходима ему для развития навыков и достижения его полноценной обучаемости.
Поддержка семьи необходима, также следует сообщать специалистам о некоторых особенностях поведения и обучения.
Оригинал: Duchenne muscular dystrophy
Перевод: Зоя Мазурова
Дюшенна (–Гризингера) (прогрессирующая) мышечная дистрофия
Син.: болезнь Мериона.
Наследственное нервно-мышечное заболевание из группы прогрессирующих мышечных дистрофий. Самая частая форма Х-сцепленной прогрессирующей мышечной дистрофии. Следующей по частоте формой является .
Ген заболевания картирован на коротком плече Х-хромосомы (локус Xp21) и наследуется по рецессивному типу. Сущность Х-сцепленного рецессивного типа наследования пояснена в статье . Там же приведены сведения о гене дистрофина (DYS), особенностях строения и функции его продукта – белка дистрофина, о дистрофинопатиях.
Частота прогрессирующей мышечной дистрофии Дюшенна варьирует от 9,7 до 32,6 на 100.000 живорождённых мальчиков. Высокая распространенность заболевания в популяции в значительной мере связана с высокой частотой новых мутаций гена дистрофина, самого крупного из известных генов человека. Средняя ожидаемая продолжительность жизни составляет 25 лет.
Крайне редко возможно развитие заболевания у девочек. Причин для этого может быть несколько: делеция на одной из Х-хромосом, вовлекающая локус Xp21; перестройка Х-хромосомы с вовлечением Xp21, или полное отсутствие одной из Х-хромосом (напр., при синдроме (Шерешевского–)Тёрнера); однородительская дисомия Х-хромосомы; сложная гетерозиготность по двум мутациям гена DYS; неслучайная инактивация Х-хромосомы.
В патогенезе заболевания, помимо непосредственного дефекта дистрофина, играют роль и иммунопатологические механизмы. У пациентов имеет место хронический воспалительный процесс и нарушение процессов регенерации. Реакции воспалительного каскада запускаются вскоре после рождения и обусловлены повышением содержания «воспалительных» генных кластеров в 8-10 месячном возрасте. За счёт дефекта липидного бислоя сарколеммы повышается её проницаемость, особенно при мышечном напряжении; свой вклад вносит и цитотоксичность макрофагов, лизирующих сарколемму после физических нагрузок (на мембране дистрофически изменённых волокон концентрируются антигены I класса главного комплекса гистосовместимости (HLA), что делает её более уязвимой для Т-клеточно-опосредованной атаки). При этом внутриклеточная КФК выходит в кровь, а внеклеточный кальций устремляется в миоциты. Воспалительный каскад активирует выработку фиброзирующего цитокинового трансформирующего фактора роста (TGF-β1), вызывающего потерю мышечной ткани из-за нарушения процессов регенерации. Предполагается, что регенеративная способность мышечной ткани истощается за счёт дефицита клеток-спутников после непрерывно протекающих циклов дегенерации-регенерации.
Заболевание характеризуется достаточно стереотипным течением, проходя в своём развитии несколько стадий, что схематично представлено на рисунке ниже.
Типичное прогрессирование симптоматики с возрастом при миодистрофии Дюшенна (источник: http://www.prosensa.eu/img/timeline-DMD-patient.png, с изменениями)
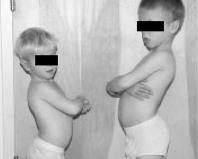
Как правило, при рождении у больных миодистрофией Дюшенна не выявляется каких-либо значимых отклонений. В первые месяцы моторное развитие детей вполне нормальное или происходит с незначительным запаздыванием. Первое, на что обращают внимание окружающие, является задержка начала ходьбы: ходить такие дети начинают, как правило, не ранее 18 месяцев. Обычно к 4-5 годам становится отчётливо заметен дефект походки: она приобретает характер «утиной», больной широко расставляет ноги, передвигается на цыпочках, развивается поясничный гиперлордоз (т.н. «генеральская» походка).

Миодистрофия Дюшенна: характерная поза при стоянии, родные братья 4 и 6 лет (источник: http://www.jaaos.org/content/10/2/138/F2/graphic-7.medium.gif)
Переваливающаяся походка обусловлена нарастающей слабостью большой и средней ягодичных мышц, лишающей больных возможности поддерживать положение тела при переносе веса на одну ногу. Гиперлордоз обусловлен слабостью разгибателей бёдер, приводящей к наклону таза вперёд и компенсаторному переразгибанию в поясничном отделе позвоночника. Из-за того, что поддерживать тело в вертикальном положении легче при эквинусной установке стопы, ребёнок начинает ходить на цыпочках, хотя к тому времени ещё не развивается клинически значимых контрактур ахилловых сухожилий.

Схематическое изображение групп мышц, вовлекаемых в процесс при миодистрофии Дюшенна (источник: http://mda.org/sites/default/files/bmd_dmd_1.jpg)
Со временем изменения походки усугубляются: появляются трудности при подъёме по лестнице, беге, ребёнок начинает падать (без спотыканий или отключений) из-за того, что «стопы как бы уходят из-под него». Типичные жалобы родителей - это ходьба детей на пальцах и частые падения.
Задержка темпов двигательного развития часто обнаруживается ретроспективно при анализе анамнестических сведений. Ранние симптомы подкрадываются незаметно. Недостаточную, по сравнению со сверстниками, подвижность ребенка, его двигательную пассивность часто относят к особенностям темперамента и характера Присоединяются затруднения при вставании из положения сидя, больной вынужден прибегать к . Пока больные сохраняют способность ходить, деформации выражены у них в минимальной степени – возможно лишь уплотнение ахилловых сухожилий и подвздошно-поясничных мышц, а также лёгкий сколиоз. За счёт поражения мышц тазового пояса затруднён и переход из горизонтального положения в вертикальное. Двигательные функции выглядят относительно стабильными между 3 и 6 годами жизни. Вовлечение мышц плечевого пояса на ранних стадиях обычно не выражено, разве только при проверке мышечной силы выявляется слабость проксимальных отделов рук. Однако оно, наряду с дистальными атрофиями конечностей и сколиозом, начинает стремительно прогрессировать после того, как больной пересаживается в инвалидное кресло. Этот переломный момент в течении заболевания обычно наступает между 7 и 13 годами жизни, и если к 13 годам больной сохраняет способность к ходьбе, следует предположить у него более мягкую форму Х-сцепленной прогрессирующей миодистрофии – .

Миодистрофия Дюшенна: характерный внешний вид колясочного больного (источник: http://babylab2.wikispaces.com/file/view/musculardys.jpg/219090918/musculardys.jpg)
Поражение мышц плечевого пояса приводит к ограничению движений в плечевых суставах. Больные не могут поднять руки выше горизонтального уровня, в то время как объем движений в локтевых и лучезапястных суставах и сила мышц длительное время остаются сохранными. При попытке поднять больного под мышки его голова как бы проваливается в плечи – симптом «свободных надплечий». Лопатки отстают от туловища - симптом «крыловидных лопаток».

Миодистрофия Дюшенна: симптом свободных надплечий (источник: http://www.ordodeus.ru/Miopatiya_5.jpg)

Миодистрофия Дюшенна: симптом крыловидных лопаток (источник: http://www.ordodeus.ru/Miopatiya_4.jpg)

Миодистрофия Дюшенна: атрофия мышц лопатки и плечевого пояса (источник: Suresh Chandran C.J. «Hidden mounts» in Duchenne muscular dystrophy // Neurol. India, 2008. – Vol.56. – N.3. – P.394)
Кроме нарастающей симметричной мышечной слабости в строго определённых группах мышц с последующей их, также симметричной, атрофией (кстати, нередко атрофии мышц маскируются хорошо развитой подкожной жировой клетчаткой), для миодистрофии Дюшенна характерны следующие симптомы:
- Умственная отсталость . Некоторая задержка развития психических функций отмечается уже в первые годы жизни. Дети малоэмоциональны. Речь развивается с запозданием и носит примитивный характер. Отсутствует абстрактное мышление. Навыки опрятности и самообслуживания формируются с трудом. Умственная отсталость различной степени: от пограничной интеллектуальной недостаточности до выраженной олигофрении развивается у 30% больных с миодистрофией Дюшенна в связи с дефицитом церебральных изоформ дистрофина - аподистрофинов. Тяжесть олигофрении и нарушений высших когнитивных функций не коррелирует с выраженностью мышечного дефекта и стадией миодистрофического процесса. К экзогенным факторам, усугубляющим проявления умственной отсталости, относят развивающуюся социальную дезадаптацию вследствие невозможности из-за двигательного дефекта полноценного участия детей в детских коллективах (сад, школа), влияние неблагоприятных перинатальных причин и, возможно, дисгенезий головного мозга (при КТ и МРТ изредка обнаруживают признаки церебральной атрофии). У детей, страдающих миодистрофией Дюшенна, чаще, чем в среднем в популяции, выявляются расстройства аутистического спектра.
- Снижение, а позднее и утрата сухожильных рефлексов. В первую очередь снижаются коленные, затем остальные рефлексы. Исключением являются ахилловы рефлексы, которые могут сохраняться вплоть до поздних стадий болезни.
- Псевдогипертрофия некоторых групп мышц на фоне атрофического процесса . Наиболее характерны псевдогипертрофии икроножных мышц, хотя они могут развиваться и в других мышечных группах (ягодичных, дельтовидных мышцах, мышцах живота и языка). Псевдогипертрофия икроножных мышц создает обманчивое впечатление о сохранности мышечной силы и даже радует родителей. Атрофия мышц может быть локальной и генерализованной. Локальная выявляется лишь на ранних стадиях заболевания, по мере прогрессирования патологического процесса атрофия приобретает генерализованный характер вплоть до мышечной кахексии. Атрофированные мышцы истончены, дряблые при пальпации.

Миодистрофия Дюшенна: характерный внешний вид больного; обращает на себя внимание псевдогипертрофия икроножных мышц (источник: http://www.jaaos.org/content/10/2/138/F2/graphic-6.medium.gif)

Миодистрофия Дюшенна: макроглоссия за счёт псевдогипертрофии мышц языка (источник: http://neuromuscular.wustl.edu/pics/people/patients/tonguehypertdmdsm.jpg)
- Изменения внешности. При слабости и атрофии мышц лица отмечается отсутствие морщин на лбу (симптом «полированного лба»). Наблюдается гипомимия: больные не могут плотно зажмурить глаза, надуть щеки, вытянуть губы в трубочку и т. д. В некоторых случаях вследствие замещения губных мышц соединительной и жировой тканью губы утолщаются (напоминают «губы тапира»).
Миодистрофия Дюшенна: характерный внешний вид больного с фотографии, выполненной самим Дюшенном (источник: http://www.artandmedicine.com/biblio/images/duchenne/DuchenneAlbum16.jpg)
- Эндокринные расстройства. Прежде всего, к ним относится ожирение. Нейроэндокринные нарушения встречаются почти у половины пациентов. Чаще других наблюдаются , . Встречается низкорослость.
- Изменения костной системы. Поясничный гиперлордоз, кифосколиоз грудного отдела позвоночника, деформации грудной клетки и стоп, диффузный остеопороз (за счёт малоподвижного образа жизни, приёма глюкокортикостероидов). На рентгенограммах обнаруживают сужение костномозгового канала, истончение коркового слоя диафизов длинных трубчатых костей.
- Сердечно-сосудистые расстройства . Клинически проявляются лабильностью пульса, артериального давления, иногда глухостью тонов и расширением границ сердца. На ЭКГ регистрируются изменения миокарда (блокада ножек пучка Гиса и др.). Сердечно-сосудистая система вовлекается в патологический процесс достаточно часто и рано. Около 73% больных имеют различные проявления кардиальной патологии. Причиной сердечно-сосудистой патологии является генетически детерминированный недостаток дистрофина в кардиомиоцитах. Отсутствие четкой корреляции между тяжестью поражения скелетных мышц и наличием выраженной кардиомиопатии у пациентов с миодистрофией Дюшенна предопределило необходимость обратить особое внимание на исследование маркеров вовлечения сердечной мышцы в патологический процесс. Оказалось, что делеции гена дистрофина являются не единственной причиной поражения мышечной ткани у пациентов с прогрессирующей мышечной дистрофии Дюшенна. В настоящее время ученые выделяют три основных причины: дефицит дистрофина, обусловленный генетическим дефектом; дефицит дистрофин-ассоциированного гликопротеина (молекулярная масса 50 кДа) или других дистрофинассоциированных белков, наличие особого генетического варианта строения ангиотензин-конвертирующего фермента. Сердечная мышца может поражаться как вследствие всех трех причин, так и их комбинаций. Например, дефицит дистрофин-ассоциированного гликопротеина может наблюдаться исключительно в кардиомиоцитах, в то время как в склетной мышечной ткани его содержание будет нормальным. Обнаружение дефицита дистрофин-ассоциированных белков при исследовании биоптата сердечной мышцы является предиктором развития тяжелой кардиомиопатии. Особое внимание последние годы уделяется строению ангиотензин-конвертирующего фермента: предполагается, с ним связана выраженность кардиомиопатии. Выявление маркеров вовлечения сердечной мышцы в патологический процесс позволяет ответить на исключительно важный практический вопрос – почему кардиомиопатия может наблюдаться у пациентов с легкими вариантами поражения скелетных мышц, а также возможность дебюта заболевания с кардиомиопатии. Как правило, начальные проявления кардиальной патологии у больных возникают уже в раннем возрасте и прогрессируют с годами. В отдельных случаях, у детей 3-5 лет, в клинической картине заболевания могут преобладать кардиальные симптомы, а симптомы мышечной дистрофии могут быть маскированными. Низкая физическая активность пациентов с прогрессирующей мышечной дистрофии Дюшенна, относительно быстрая утрата способности к самостоятельной ходьбе, снижающая нагрузку на миокард, а также недостаточная нацеленность родителей на выявление кардиальных жалоб (основное внимание обращается прежде всего на двигательные нарушения), приводят к тому, что менее 15% детей до 14 лет, имеющих поражение мышцы сердца, активно обращаются к кардиологу. В то время как по данным целевых исследований у детей, не предъявляющих кардиальных жалоб, поражение мышцы сердца выявляется у 25% в возрасте до 6 лет и у 59% в возрасте от 6 до 10 лет. В дальнейшем этот процент снижается, поскольку поражение сердца прогрессирует и дети начинают предъявлять кардиальные жалобы. Патогенез поражения мышцы сердца при миодистрофии Дюшенна в настоящее время представляется следующим образом: прогрессирующая атрофия кардиомиоцитов и замещение их фиброзной тканью приводят к истончению миокарда (особенно левого желудочка, на который приходится основная гемодинамическая нагрузка), а также к снижению его способности к систолическому сокращению и диастолическому расслаблению. Выраженный фиброз в области задних папиллярных мышц ведет к пролабированию створок митрального клапана в полость левого предсердия (пролапс митрального клапана) с или без наличия митральной регургитации. Частота выявления пролапса митрального клапана у пациентов с прогрессирующей мышечной дистрофии Дюшенна составляет от 25 до 55%. Увеличение размеров левого предсердия как правило вторично, вследствие митральной регургитации или снижения сократительной способности левого желудочка. Нарушения ритма сердца и проводимости возникают вследствие прогрессирующего фиброза проводящей системы сердца. Обычно поражение сердечной мышцы впервые диагностируется между 6 и 7 годами. С возрастом частота выявления кардиальных симптомов возрастает, и к 20 годам патология сердечно- сосудистой системы встречается у 95% больных. Наиболее частыми нарушениями, наблюдавшимися у 54% пациентов, были: тахикардия, аритмии и сердечная недостаточность. Особенно выражены данные симптомы в конечных стадиях заболевания. Учитывая особенности двигательной активности пациентов с миодистрофией Дюшенна (а также с ), отсутствие кардиальных жалоб, весьма малую физическую активность, часто обездвиженность на поздних этапах заболевания, в 1993 году был предложен и введен в медицинскую практику новый диагностический термин – латентная сердечная недостаточность.
- Патология системы органов дыхания . Слабость дыхательной мускулатуры и диафрагмы обусловливает уменьшение жизненной ёмкости лёгких до 20% от нормы, что приводит к эпизодам ночной гиповентиляции. Дети часто встают со страхом, связанным с ощущением удушья, и боятся спать. Существенный вклад в летальность вносит дыхательная недостаточность, которая провоцируется интеркуррентными инфекциями или аспирацией.
Болезнь может протекать по одному из нескольких клинических вариантов, краткое описание которых приведено в таблице.
|
|
|
|
|
|
|
|
Теряет способность ходить в 10-12 лет. Генерализованная мышечная слабость, затем сколиоз, контрактуры голеностопных, коленных и других суставов | Масса тела снижена. Психическое развитие в норме; кардиомиопатия обнаруживается после 8-10 лет | ||
|
|
Теряет способность ходить в 10 лет или ранее. Генерализованная мышечная слабость, затем сколиоз, контрактуры голеностопных и других суставов | Ожирение (лунообразное лицо, отложение жира по женскому типу). Kардиомиопатия обнаруживается после 10 лет | ||
|
|
1-2-й год жизни |
Теряет способность ходить до 10 лет, иногда в 6,5-7 лет. Ранние множественные контрактуры. Быстрое прогрессирование | Масса тела снижена или в норме. Задержка психического развития. Kардиомиопатия обнаруживается в 7-10 лет | |
|
|
В 6,5-7 лет обнаруживается кардиомиопатия при небольших проявлениях мышечной слабости (затруднения при подъеме по лестнице). Относительно медленное прогрессирование | Масса тела снижена или в норме. Психическое развитие в норме | ||
|
|
Теряет способность ходить в 10-12 лет или ранее. Генерализованная мышечная слабость | Различные сочетания |
Диагностика миодистрофии Дюшенна основывается на анамнезе (в т.ч. семейном), клинической картине заболевания и ряде дополнительных методов исследования. К последним относятся:
Исследование КФК сыворотки крови . В здоровых клетках КФК катализирует синтез креатина и АТФ из фосфокреатина и АДФ. При миодистрофии Дюшенна (и, в меньшей степени, ) физические нагрузки приводят к массивному высвобождению КФК, инициирующему воспалительную реакцию. Поэтому уровень КФК сыворотки крови значительно повышен при миодистрофии Дюшенна и, в меньшей степени – . Отклонения уровня КФК сыворотки при некоторых дистрофинопатиях приведены в таблице.
|
|
Фенотип |
% случаев |
Концентрации КФК |
| Мужчины | Миодистрофия Дюшенна |
В 10 раз и более выше нормы |
|
|
В 5 раз и более выше нормы |
|||
| Дюшенн-ассоциированная дилатационная кардиомиопатия |
В большинстве случаев |
Повышена |
|
| Женщины-носительницы | Миодистрофия Дюшенна |
В 2-10 раз выше нормы |
|
|
В 2-10 раз выше нормы |
С возрастом концентрация КФК постепенно падает, по мере резорбции дистрофических мышечных волокон.
ЭНМГ . Позволяет отдифференцировать первично-мышечное поражение от нейрогенного. При первом выявляются быстро рекрутируемые, короткие по длительности полифазные низкоамплитудные потенциалы двигательных единиц. По мере прогрессирования заболевания интерференционный паттерн ЭНМГ становится редуцированным за счёт снижения рекрутирования, и в конце концов регистрируется биоэлектрическое «молчание» мышцы. Данные ЭНМГ не являются специфичными и одинаковы при любой форме первично-мышечного поражения. Поэтому на практике ЭНМГ в диагностике миодистрофии Дюшенна используется достаточно редко.
Биопсия скелетных мышц . Производится для гистологического исследования биоптата, а также проведения иммуногистохимических тестов и вестерн-блоттинга. Гистологически на ранних стадиях заболевания выявляются неспецифические дистрофические изменения – вариабельность размеров волокон, очаги некроза и регенерации, гиалинизация; на поздних стадиях – отложения жира и разрастание соединительной ткани.

Миодистрофия Дюшенна, срез биоптата мышцы, окрашенный гематоксилин-эозином. Отмечается выраженный фиброз эндо- и перимизия, выраженная вариабельность диаметра мышечных волокон за счёт наличия атрофированных и гипетрофированных волокон (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870086.jpg)

Миодистрофия Дюшенна, срез биоптата мышцы, окрашенный гематоксилин-эозином. Два мышечных волокна, занимающих бóльшую часть среза,на самом деле представляют собой единое гипертрофированное волокно, расщеплённое новообразованной соединительнотканной перемычкой (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870088.jpg)

Миодистрофия Дюшенна, срез биоптата мышцы, окрашенный гематоксилин-эозином. Видно некротизированное мышечное волокно с бледной цитоплазмой в стадии миофагоцитоза. Кроме того, на срезе видны следующие признаки миодистрофического процесса: увеличение числа ядер мышечных волокон, аномально высокая вариабельность диаметра мышечных волокон, два гиалинизированных мышечных волокна (сразу под некротизированным) и выраженный фиброз

Миодистрофия Дюшенна, срез биоптата мышцы, окрашенный гематоксилин-эозином. Некоторые волокна выглядят крупными, более красноватыми и «стекловидными». Они называются «гиалинизированными» или «тёмными» и представляют собой избыточно сокращённые мышечные волокна. На срезе также видна аномальная вариабельность диаметра волокон, локальный некроз мышечных волокон, умеренное увеличение числа ядер мышечных волокон и выраженный фиброз эндо- и перимизия. Следует заметить, что гиалинизированные волокна могут встречаться как артефакты (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870089.jpg)

Срез биоптата икроножной мышцы больного, погибшего от миодистрофии Дюшенна. Видно массивное замещение мышечной ткани жировыми клетками (источник: http://upload.wikimedia.org/wikipedia/commons/thumb/4/49/Duchenne-muscular-dystrophy.jpg/800px-Duchenne-muscular-dystrophy.jpg)
Чтобы повысить специфичность диагностики, используется иммуногистохимическое исследование с определением процентного содержания дистрофина в мышечных волокнах, полученных при биопсии мышц, путём прокрашивания антидистрофиновыми антителами к С-концу, срединному участку и N-концу молекулы дистрофина. При окрашивании этим методом интактной мышечной ткани выявляется равномерное распределение красителя по периферии мышечных волокон, соответствующее субсарколеммной локализации дистрофина.

Ииммуногистохимический анализ биоптата здоровой мышцы на дистрофин. На срезе, прокрашенном антителами к дистрофину, видно равномерное субсарколеммальное коричневое окрашивание мембраны всех мышечных волокон (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870093.jpg)
При миодистрофии Дюшенна субсарколеммальное окрашивание не выявляется при использовании антител к С-, N-концам и срединному участку (при – только при использовании антител к N-концу).

Миодистрофия Дюшенна, иммуногистохимический анализ биоптата мышцы на дистрофин. Ни одно из мышечных волокон (за исключением единственного, отмеченного на рисунке стрелкой) не прокрашивается антителами к дистрофину. Идентичный результат получается при окрашивании антителами к С-концу, N-концу и срединному участку дистрофина (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870095.jpg)
В редких случаях единичные волокна могут сохранять окрашивание при иммуногистохимическом исследовании (как раз такое волокно отмечено стрелкой на предыдущем рисунке). Это происходит благодаря второй мутации в гене дистрофина, восстанавливающей рамку считывания и оставляющей таким образом возможность синтеза дистрофина в данном волокне. Эти наблюдения открывают перспективы для разработки одного из потенциальных направлений лечения миодистрофий.
Возможно также иммуногистохимическое исследование биоптата мышцы на утрофин – аутосомный гомолог дистрофина, который синтезируется в постнатальном периоде главным образом в нервно-мышечных соединениях. При дистрофинопатиях экспрессия утрофина повышена и он может определяться в сарколемме.

Иммуногистохимический анализ биоптата мышцы на утрофин в норме (А) и при миодистрофии Дюшенна (В). На рисунке А представлена картина экспрессии утрофина в норме у детей и взрослых: волокна не окрашиваются, утрофин определяется лишь в стенке сосудов. На рисунке В показана активация экспресии утрофина при дистрофинопатии:сарколеммы интенсивно окрашиваются, что может быть отражением компенсаторного синтеза утрофина в условиях дефицита дистрофина. Участки просветления в цитоплазме мышечных волокон соответствуют артефактам в виде микрокристаллов льда (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870172.jpg)
Вестерн-блоттинг – современный высокочувствительный аналитический метод, используемый для определения специфичных белков в сложных смесях с помощью антител. Метод основан на комбинации гель-электрофореза и иммунохимической реакции «антиген-антитело». С помощью гель-электрофореза белки разделяются в полиакриламидном геле. Далее белки переносят на нитроцеллюлозную или PVDF-мембрану. Затем их детектируют с использованием антител методом «сэндвича»: сначала белки связываются с первичными (моно- или поликлональными) антителами, которые в свою очередь связываются со вторичными антителами, конъюгированными с ферментами (пероксидазой хрена или щелочной фосфатазой). Визуализация исследуемого белка достигается путем проведения соответствующей биохимической реакции с образованием продукта, который определяется колориметрическим, хемилюминесцентным, флюоресцентным методами детекции. Количество белка может быть оценено с помощью денситометрии. Высокая степень разрешения достигается за счет электрофоретического разделения белков и специфичности моноклональных антител. В оптимально отработанных условиях вестерн-блоттингом можно обнаруживать антиген в количествах менее 1нг. Метод применяется для верификации положительных результатов иммуногистохимического исследования. При миодистрофии Дюшенна количество дистрофина составляет 0-5% от нормы.
Генетический анализ крови . Это в настоящее время самый точный метод диагностики миодистрофии Дюшенна (и других дистрофинопатий), который благодаря своей высокой информативности зачастую является единственным дополнительным методом диагностики этого заболевания за рубежом. Это обусловлено тем, что дистрофинопатии развиваются исключительно при мутациях одного гена – гена DYS. Для проведения исследования необходимо 2 мл венозной крови. Исследование проводится методами поиска делеций/дупликаций и анализа (сканирования) мутаций, является достаточно трудоёмким и финансово затратным.
Возможна пренатальная диагностика миодистрофии Дюшенна методами молекулярно-генетического исследования (анализ ДНК клеток плода на характерные мутации), биопсии мышц плода и преимплантационной генодиагностики.
Лечение миодистрофии Дюшенна к настоящему времени не разработано. Существуют лишь способы несколько замедлить прогрессирование заболевания и улучшить качество жизни пациентов.
К медикаментозной терапии, влияющей на течение заболевания, относятся:
Приём глюкокортикостероидов. Доказано, что если начать глюкокортикостероидную пероральную терапию в то время, когда становится заметной остановка физического развития ребёнка (как правило, в возрасте 4-6 лет), происходит заметная задержка прогрессирования утраты мышечной массы, нарастание мышечной силы и улучшение функционального состояния пациента. Если же глюкокортикостероиды назначить, когда ребёнок уже утратил способность к передвижению, эффективность их близка к нулю. При этом объяснить действие этой группы препаратов лишь иммуносупрессией невозможно, т.к. назначение иммунодепрессанта азатиоприна больным с миодистрофией Дюшенна, как показали исследования, не сопровождается каким-либо лечебным эффектом. Оптимальным режимом терапии преднизолоном считается ежедневный приём per os в дозе 0,75 мг/кг/сут (но не более 40 мг/сут) до появления значимых побочных эффектов, после чего производится постепенное снижение дозы до 0,5 мг/кг/сут, а в случае сохранения серьёзных побочных эффектов – до 0,3 мг/кг/сут. Альтернативной схемой является приём в тех же дозах через день или «интермиттирующий» приём (10 дней приёма, 10-20 дней перерыв). Лицам, у которых на фоне ежедневного приёма преднизолона развивается ожирение и поведенческие расстройства, можно рекомендовать переход на приём в дозе 5 мг/кг два дня в неделю (например, по пятницам и субботам). Положительный эффект (нарастание мышечной силы) отмечается уже к 10-му дню от начала лечения. В европейских и некоторых других странах используется синтетическое прозводное преднизолона – дефлазакорт (производится в Великобритании, Испании, Индии, Бразилии, Панаме и Гондурасе). Показано, что он в меньшей степени вызывает побочные эффекты, особенно что касается ожирения, однако, при его применении чаще развивается бессимптомная катаракта. Дозировка дефлазакорта – 0,9 мг/кг/сут (но не более 39 мг/сут). Многие специалисты рекомендуют оставлять пациента на поддерживающей дозе глюкокортикостероидов и после того, как он пересел в инвалидную коляску: это позволяет дольше сохранить силу в руках, замедлить прогрессирование кардиореспираторных нарушений и развитие сколиотической деформации позвоночника. К основным побочным эффектам длительной глюкокортикостероидной терапии относятся: поведенческие расстройства, задержка роста, ожирение, остеопороз, нарушение толерантности к глюкозе, иммуносупрессия, надпочечниковая недостаточность, диспепсия, пептические язвы, катаракта, кожные проявления. С большинством из них можно бороться, не снижая дозы препарата.
Приём агонистов β 2 -адренорецепторов. В нескольких рандомизированных исследованиях показан положительный эффект β 2 -агонистов на мышечную силу, однако, на течение заболевания они влияния не оказывают. Эти вещества используются для лечения бронхиальной астмы и включают такие препараты, как сальбутамол, формотерол и др.
Приём других лекарственных препаратов. Возможно, некоторый положительный эффект на течение заболевания оказывают аминокислоты, карнитин, коэнзим-Q10, рыбий жир, экстракт зелёного чая и витамин Е.
Приём кардиотропных препаратов. Около 2/3 больных миодистрофией Дюшенна испытывают те или иные кардиологические проблемы и, пожалуй, самая существенная из них – развитие дилатационной кардиомиопатии. При появлении у больного её эхокардиографических (или клинических) признаков назначаются ингибиторы АПФ; если через 3 месяца лечения улучшения не происходит, добавляют β-адреноблокаторы (карведилол или метопролол). В случае прогруссирующего течения присоединяют диуретики, препараты наперстянки.
Немедикаментозные методы. Поощряется посильная физическая активность: малоподвижный образ жизни ускоряет прогрессирование мышечной дисфункции. Показаны также физиотерапевтические процедуры и занятия с логопедом. Используется также искусственная вентиляция лёгких, различные ортопедические приспособления, моторизованные инвалидные коляски.
Несмотря на все эти мероприятия, прогноз заболевания в целом неблагоприятный: большинство больных погибают в возрасте около 25 лет, чаще всего от респираторных расстройств.
В настоящее время в мире проводятся исследования, направленные на разработку новых перспективных методов лечения миодистрофии Дюшенна.
Генная терапия. Несмотря на очевидные успехи в исследованиях структуры гена дистрофина, его продуктов, и в выяснении биомеханизмов заболевания, реальных успехов в генотерапии миодистрофии Дюшенна пока не достигнуто. Причиной этого являются, по-видимому, не только гигантские размеры гена и его матричной РНК (мРНК), но и, главным образом, отсутствие эффективных средств доставки гена в мышцы, а также развитие иммунного ответа на введение гена. Считается, что достижение терапевтического эффекта возможно при успешной трансфекции не менее 20%, а по последним данным даже 40% всех мышечных волокон не только скелетной мускулатуры, но так же мышц сердца и диафрагмы. При этом основными критериями эффективности трансфекции являются: появление дистрофин-положительных мышечных волокон, нормализация уровня биохимических маркеров миодистрофии Дюшенна, изменения физиологических параметров (силы мышц и др.).
В активно разрабатываемых в настоящее время генотерапевтических подходах можно выделить несколько направлений: 1) коррекция дефекта путем введения нормальных копий комплементарной ДНК (кДНК) гена дистрофина в составе рекомбинантных вирусных частиц или посредством невирусных способов доставки; 2) коррекция мутаций на уровне геномной копии гена или на его первичном РНК-транскрипте; 3) активация в мышечных волокнах и клетках репрессированного в ходе онтогенеза аутосомного гомолога гена дистрофина – гена утрофина.
Трансфекция мышечных волокон с использованием вирусных векторов . Эксперименты проводились как с ретровирусными векторами, несущими укороченную кДНК «мини»-гена DYS, так и с аденовирусными векторами, способными нести полноразмерную кДНК этого гена. В экспериментах на мышах удалось продемонстрировать достаточно эффективную и долговременную трансфекцию скелетных и сердечной мышц после внутривенного введения рекомбинантного аденовируса с кДНК гена дистрофина. Была так же продемонстрирована принципиальная возможность трансфекции и синтеза дистрофина в мышцах диафрагмы mdx-мышей (лабораторная популяция мышей с дефектами гена DYS) с использованием полноразмерной кДНК гена дистрофина человека. Кроме нормализации синтеза дистрофина, удалось показать, что сверхэкспрессия этого гена (уровень белка в 50 раз выше нормы) не оказывает вредных побочных эффектов. Вместе с тем, использование вирусных носителей, особенно в экспериментах in vivo, наталкивается на существенные методические трудности. К ним относятся – недостаточная пакующая способность у ретровирусов, необходимость наличия клеток-хелперов. Наибольшим серьезным препятствием к использованию вирусных векторов для доставки генетических конструкций является выраженный иммунный ответ на вирусные антигены. Несмотря на огромный объем работ по модификации генома вируса носителя, сокращения размера вирусного генома до минимально возможного размера, иммунный ответ тем не менее сохраняется и делает бессмысленными повторные введения генных конструкций. Тем не менее работы по совершенствованию вирусных способов доставки не прекращаются. Наиболее перспективно введение гена дистрофина новорожденным мышам. Было продемонстрировано, что в результате трансфекции мышат аденовирусным вектором и компактизацией ДНК полилизином pK8, экспрессия дистрофина регистрировалась в течении почти 1 года.
Невирусные способы доставки кДНК гена дистрофина . Невирусные способы доставки включают баллистическую трансфекцию, методы электропорации (электрошока), введение генетических конструкций в составе липосом или упакованных с помощью олигопептидов, молекулярных коньюгатов, полимерных носителей. Эти носители в значительной мере лишены недостатков присущих вирусным векторам, однако, способность к трансформации у большинства из них ниже, чем у вирусных векторов. Первые эксперименты по доставке «голой» плазмидной ДНК с кДНК гена дистрофина человека показали возможность трансфекции и появление дистрофин-положительных мышечных волокон у mdx-мышей.
Наиболее продвинутыми на сегодняшний день являются исследования по доставке гена дистрофина методом электропорации или с носителем на основе полимерной формы декстрана. В последнем случае для доставки гена дистрофина использовали декстран, обеспечивающий самособирающийся ДНК полимерный комплекс. Отсутствие токсичности и иммунного ответа, диссеминация по различным группам мышц и достаточно длительная (более двух месяцев) экспрессия показали перспективность данной системы доставки для проведения клинических испытаний.
Еще более обнадёживающие результаты получены в экспериментах на мышах, крысах, кроликах и обезьянах по доставке генетических конструкций в мышцы с помощью электропорации. Восьмикратный электрический импульс (200 V/cm 2 , 20 мсек, 17 Гц), через 30 секунд после введения плазмид с геном β-галактозидазы LacZ приводил к синтезу β-галактозидазы в 76% мышечных волокон, а с использованием электрошока только в 8%.
Генная терапия на уровне первичного транскрипта гена дистрофина . Из этих методов особое внимание привлекает техника направленной утраты экзона, несущего мутантный стоп-кодон, разработанная в лаборатории Джорджа Диксона в Великобритании. Работа выполнялась in vitro на миобластах mdx-мышей mdx с нонсенс-мутацией в 23 экзоне гена дистрофина. В условиях in vitro было показано что уже через 6 часов после трансфекции специфическими олигонуклеотидами (антисенс-олигонуклеотидами) удаление мутантного 23 экзона происходило в 50% мРНК и в 100% мРНК через 24 часа. Перспективность данного подхода заключается в том, что миобласты начинают синтезировать полноразмерный белок дистрофина, хотя и дефектный по одному функционально несущественному экзону. Будучи пересаженными больному модифицированные миобласты смогут восстанавливать функцию и предотвращать гибель пораженных мышечных волокон.
Учитывая оригинальность метода и его большие перспективы, остановимся на кратком разъяснении его сути. Напомним, что белок дистрофин выполняет «якорную» функцию, соединяя белки «скелета» мышечного волокна с соединительнотканными структурами, окружающими мышечное волокно. Он служим «амортизатором», предохраняющим мышечное волокон от повреждения в процессе сокращения и расслабления мышцы. Схематически можно представить дистрофин в виде верёвки, соединяющей якорь и лодку. Якорь может выполнять свою функцию только если соединён с лодкой верёвкой.

Схематическое представление «якорной» функции дистрофина (
Врожденная слабость в мышцах, которая прогрессирует с развитием организма, в медицине получила название «миодистрофия Дюшенна». Эта болезнь встречается исключительно у лиц мужского пола. Понимание природы патологии позволяет облегчить ее течение и помочь детям справиться с начальными проявлениями.
Характеристика недуга
Мышечная дистрофия Дюшенна — это генетическая патология, обусловленная нарушением структуры мышечных волокон. Постепенно они распадаются, а человек утрачивает способность к передвижению. Заболевание проявляет себя уже в грудном возрасте. Сначала возникают мышечные нарушения, затем присоединяются скелетные деформации. Клиническая картина дополняется эндокринными и умственными расстройствами.
Впервые миодистрофия была описана в 1861 году французским невропатологом, именем которого была позднее названа. Она диагностируется довольно часто: 1 случай на 3500 новорожденных малышей. Радикального способа лечения не существует. Предлагаемая врачами терапия носит исключительно симптоматический характер. Больные с этим диагнозом редко переживают рубеж в 30 лет.
Основные причины
Мышечная дистрофия является следствием отклонения в генетическом коде ДНК. Мутация возникает в расположенном в Х-хромосоме гене. Один из его участков отвечает за выработку особого белка — дистрофина. Это вещество на микроскопическом уровне составляет базис мышечных волокон и выполняет несколько функций:
- поддержание клеточного скелета;
- обеспечение способности мышечных волокон к сокращению и расслаблению.
При этом заболевании дистрофин отсутствует или плохо синтезируется. Уровень «нормального» белка не превышает отметки в 3 %. Такая мутация приводит к разрушению волокон в мышцах. Они постепенно перерождаются, замещаются жировой и соединительной тканью. Как следствие, человек утрачивает способность к передвижению.
Какой имеет мышечная дистрофия Дюшенна тип наследования? Заболевание передается по рецессивному признаку. В организме человека все гены парные. Чтобы при наследственном недуге появились патологические нарушения, генетический дефект должен возникнуть в одной хромосоме или в аналогичных участках обеих. Во втором случае речь идет о рецессивном типе наследования.
Если генетический дефект диагностируется только в одной хромосоме, но болезнь при этом прогрессирует, говорят о доминантном признаке передачи. Рецессивный тип возможен при одномоментном поражении одинаковых ДНК-структур. Когда вторая хромосома абсолютно «здорова», патология не развивается. Поэтому дистрофия диагностируется только у лиц мужского пола. У них в генетическом наборе присутствует одна Х-хромосома, а вторая (У) — парная.
Что наука говорит о представительницах прекрасного пола? Мышечная дистрофия Дюшенна у девочек диагностируется редко. Для этого в генотипе должны совпасть две патологические Х-хромосомы, что маловероятно. Девочки могут выступать только носителями недуга и передавать его сыновьям.

Общая клиническая картина
Заболевание откладывает свой отпечаток на нервно-мышечную систему. Его проявления можно наблюдать у детей в возрасте 2-3 лет. Родители начинают замечать, что малыш отстает в физическом развитии от сверстников. Патологический процесс быстро прогрессирует и распространяется уже на нижние конечности. Затем он переходит на другие участки мускулатуры.
Повреждение мышечного корсета и чрезмерные нагрузки приводят к искривлению конечностей. У больных детей также наблюдаются изменения в функционировании сердца, задержка умственного развития.
Все патологические проявления недуга можно разделить на несколько групп:
- поражение скелетной мускулатуры;
- сбои в работе сердца;
- деформация скелета;
- умственные расстройства;
- эндокринные нарушения.
Рассмотрим клинические проявления каждой из групп более подробно.
Поражение скелетной мускулатуры
Дети появляются на свет без серьезных проблем со здоровьем. Однако уже через несколько месяцев их двигательное развитие начинает отставать. Такие малыши менее активные. Врачи и родители еще не замечают явных отклонений, списывая все на особенности темперамента.
Начальные симптомы заболевания возникают после первых шагов. Дети с дистрофией Дюшенна постоянно падают и передвигаются на носочках. Если большинство сверстников уже уверенно стоит на ногах, они упорно продолжают испытывать трудности с передвижением.
Следующим этапом проявления недуга является период, когда малыши обретают способность к разговору. Они начинают жаловаться родителям на слабость и быструю утомляемость. Прыжки на детской площадке, бег, лазанье по турникам — все эти виды активности не приносят им удовольствия.
Какие еще имеет мышечная дистрофия Дюшенна симптомы? Нарушение Говерса считается своеобразным проявлением заболевания. При каждой попытке встать с пола ребенок пользуется руками, чтобы помочь таким образом слабым мышцам ног. С этой целью он опирается конечностями на себя, перебирая ими по всему телу.
Постепенное прогрессирование недуга приводит к тому, что больные дети к 10-12 годам утрачивают навык самостоятельно передвигаться. Большинство из них нуждается в инвалидном кресле. Способность держать тело в вертикальном положении сохраняется только до 16 лет.

Деформации скелета
К данной группе относятся сопутствующие мышечным нарушениям симптомы. Мышечная дистрофия Дюшенна проявляется усилением поясничного изгиба, что дополняется искривлением грудного отдела позвоночника и сутулостью. У многих малышей меняется форма стопы. С течением времени развивается выраженный остеопороз. Перечисленные симптомы еще больше усугубляют клиническую картину, способствуют ухудшению двигательных нарушений.
Сбои в работе сердца
Прогрессирующая мышечная дистрофия обязательно сопровождается поражением сердечной мышцы. Как правило, развивается кардиомиопатия. Клинически она проявляет себя перепадами давления, нарушением сердечного ритма. Границы главной мышцы организма увеличиваются, но при этом ее функциональные возможности резко сокращаются. В результате возникает сердечная недостаточность.
Сочетание перечисленных пороков с дыхательной дисфункцией часто становится причиной летальной исхода.
Умственные расстройства
Данный симптом считается необязательным, но возможным. Его появление может быть обусловлено дефицитом одной из разновидностей дистрофина — аподистрофина, который содержится в головном мозге. При этом слабые мышцы и выраженность умственных нарушений не взаимосвязаны. Невозможность ребенком посещать детский сад и школу только усиливает когнитивные расстройства.

Эндокринные нарушения
Различного рода эндокринные нарушения диагностируются у 30-50 % больных. Они могут быть выражены в форме ожирения или недоразвития половых органов. Избыточные отложения чаще всего наблюдаются в области молочных желез, плечевого пояса и ягодиц. Больные с дистрофией Дюшенна, как правило, имеют низкий рост.
Медицинское обследование
Диагностика миодистрофии Дюшенна базируется на нескольких видах исследований, главным из которых является ДНК-тест. Выявление дефекта у Х-хромосомы на участке, отвечающем за синтез дистрофина, считается окончательным подтверждением диагноза.
Среди других методов диагностики сегодня применяют:
- КФК (определение активности креатинфосфокиназы). Этот фермент является прямым отражением гибели мышечных волокон. У детей с дистрофией Дюшенна его показатель превышает норму в сотни раз.
- Электромиография.
- Дыхательные пробы, ЭКГ, УЗИ сердца. Позволяют выявить отклонения в работе других систем органов.
- Биопсия мышц. С помощью этого метода определяется содержание дистрофина в организме.
Прогрессирующая мышечная дистрофия у ребенка означает, что в генотипе матери присутствует патологическая Х-хромосома. Лишь в единичных случаях женщина оказывается полностью здоровой. Наличие дефектного гена представляет угрозу для последующих беременностей. Поэтому таким семьям рекомендуется посетить генетика.
При наступлении повторной беременности семейной паре предлагают так называемую пренатальную диагностику. Она подразумевает под собой исследование генотипа ребенка еще в утробе. Такое исследование позволяет исключить риск наследственных заболеваний, в число которых входит мышечная дистрофия Дюшенна.
Пренатальная диагностика основывается на использовании клеточного материала. Его получают посредством различных процедур: биопсия хориона, амниоцентез и др. Перечисленные манипуляции несут определенный риск для плода, но с их помощью можно со 100%-й гарантией диагностировать генетическое заболевание.

Медикаментозное лечение
Мышечная дистрофия Дюшенна является неизлечимым заболеванием. Но пациенты с таким диагнозом не должны оставаться прикованными к постели. Чтобы помочь ребенку продлить период двигательной активности, современная медицина предлагает несколько способов.
Из лекарственных препаратов с этой целью больным назначают стероиды и бета-адреномиметики. Применение последних («Альбутерол», «Формотерол») не имеет достоверного признания. Поэтому говорить об их эффективности сегодня не приходится. Такие препараты используются исключительно в качестве экспериментального лечения.
Основу терапии составляют стероиды. Регулярное их применение позволяет на некоторое время восполнять мышечную силу. Врачи предполагают, что такие препараты могут затормозить прогрессирование недуга, а также предупредить возникновение сколиоза. Однако возможности стероидов ограничены. Мышечная дистрофия Дюшенна в любом случае продолжит развиваться.
Дополнительно пациентам назначают сердечные средства. Это прежде всего ингибиторы АТФ, антиаритмические и метаболические медикаменты. Они позволяют противостоять кардиологическим аспектам болезни.

Физиотерапия и ортопедическая помощь
Немедикаментозная терапия предполагает назначение физиопроцедур и ортопедическую помощь. В первом случае речь идет о различных техниках массажа и плавании. Физиотерапевтическое воздействие помогает дольше сохранять подвижность и гибкость суставов. Умеренная активность благоприятно воздействует на течение болезни. С другой стороны, бездействие и постельный режим могут лишь усугубить клиническую картину. Поэтому врачи рекомендуют как можно дольше поддерживать физическую активность.
Ортопедическая помощь является важной составляющей терапии для пациентов с диагнозом «мышечная дистрофия Дюшенна». Лечение лекарственными средствами вкупе со специальными приспособлениями позволяет существенно облегчить им жизнь. Их перечень весьма разнообразен: различные вертикализаторы, приспособления для самостоятельного принятия удобного положения, инвалидные коляски с электрическим приводом, корсеты для позвоночника, шины для ног и многое другое.

Прогноз для больных
Миодистрофия Дюшенна — это серьезное генетическое заболевание, первые признаки которого обнаруживаются у детей первых месяцев жизни. Сначала мальчики испытывают трудности при ходьбе, затем не могут элементарно встать с пола. Медикаментозное лечение стероидами существенно меняет течение патологического процесса. Препараты помогают на некоторое время восстановить мышечную силу.
Спрогнозировать, когда именно пациент начнет пользоваться инвалидным креслом, достаточно трудно. Обычно потребность в этом устройстве появляется в возрасте 8-11 лет. С дальнейшим развитием мышечной слабости больному становится трудно сохранять положение тела, могут возникнуть осложнения.
Какой при диагнозе «мышечная дистрофия Дюшенна» прогноз дают врачи? Заболевание может существенно сократить продолжительность жизни. Однако в настоящее время большинство юношей достигает взрослой жизни, но при условии качественной медицинской и физиотерапевтической помощи.
Мышечная дистрофия Дюшенна - редкое заболевание. Другое её название — миодистрофия Дюшенна или прогрессирующая мышечная дистрофия Дюшенна. Название обусловлено тем, что болезнь быстро прогрессирует. Заболевание встречается примерно у 3 человек из 100000. Патология вызвана врождённой генетической аномалией, протекает тяжело и поражает большую группу мышц. С течением времени дистрофия мышечной системы приводит к полной невозможности самостоятельно передвигаться.
Миодистрофия Дюшенна приводит к патологии и других органов, что существенно сокращает продолжительность жизни человека.
Подавляющее большинство больных мышечной дистрофией Дюшенна - мальчики. Девочки страдают этим заболеванием крайне редко. Это врождённая болезнь, которая вызвана изменениями в X- хромосоме . На участке X-хромосомы есть ген, который контролирует продукцию белка дистрофина. Этот белок влияет на целостность оболочек мышечных волокон (сарколемм) и на устойчивость мышц к растяжению. А также он контролирует уровень кальция в мышечной ткани и рост мышц. Если в организме человека образуется дефицит белка дистрофина, то это ведёт к постепенному разрушению мышечных клеток (миоцитов). В мышцах происходят дегенеративные изменения, мышечные волокна атрофируются, разрушаются и заменяются жировой и соединительной тканью.
При прогрессирующей мышечной дистрофии Дюшенна резко падает содержание нормального дистрофина из-за генной мутации. Этот белок либо совсем отсутствует, либо в организме содержится дефектный дистрофин. У больных людей уровень нормального дистрофина в организме не более 3%.
 Девочки и женщины очень редко болеют таким видом мышечной дистрофии. Но они часто являются носителями изменённого гена. Это связано с путём передачи болезни через X- хромосому. Как известно, хромосомный набор мужчины - XY, а женщины - XX. Если мать мальчика имеет в своём генетическом наборе дефектную X -хромосому, то мальчик может родиться больным, даже при отсутствии болезни у отца.
Девочки и женщины очень редко болеют таким видом мышечной дистрофии. Но они часто являются носителями изменённого гена. Это связано с путём передачи болезни через X- хромосому. Как известно, хромосомный набор мужчины - XY, а женщины - XX. Если мать мальчика имеет в своём генетическом наборе дефектную X -хромосому, то мальчик может родиться больным, даже при отсутствии болезни у отца.
Девочка рождается с миодистрофией Дюшенна лишь в том случае, если мать является носителем дефектного гена, а отец страдает этим заболеванием. Такие случаи очень редки. Чаще всего девочка, рождённая от матери, являющейся носительницей дефектного гена, тоже становится носителем болезни и передаёт её своим сыновьям.
Однако прогрессирующая дистрофия Дюшенна необязательно передаётся ребёнку от родителей. Есть случаи, когда генетический сбой возникает в результате случайной мутации. Бывает и так, что больной ребёнок рождается у абсолютно здоровых родителей, не являющихся носителями дефектных генов.
Симптомы миодистрофии Дюшенна
Обычно болезнь проявляет себя в возрасте 1-5 лет. Она поражает не только мышцы скелета, но и другие органы.
- Поражение скелетных мышц - это ранний признак болезни, который возникает у маленького ребёнка.
- Прогрессирует мышечная слабость.
- Из-за поражения мышц деформируются кости скелета.
- Болезнь затрагивает не только мускулатуру скелета, но и приводит к изменениям в сердечной Некоторые дети с миодистрофией Дюшенна отстают в умственном развитии.
- Болезнь приводит к нарушениям работы эндокринных желёз.
Поражение мускулатуры скелета
Поражение мышц - это основной и ранний признак заболевания. Симптомы со стороны мышц становятся заметны в возрасте 1-5 лет.
В грудном возрасте ребёнок выглядит здоровым. Можно лишь заметить, что такие дети в возрасте до года неактивны и неохотно совершают любые движения. Чаще всего родители не придают этому значения и связывают низкую двигательную активность ребёнка с индивидуальными особенностями развития.

Болезнь прогрессирует, многие дети уже к 12 годам теряют способность ходить. Им приходится пользоваться инвалидной коляской.
В подростковом возрасте в болезненный процесс вовлекается дыхательная мускулатура. Ребёнку становится трудно дышать, его беспокоят приступы удушья, особенно по ночам. Из-за этого дети боятся спать. Это может привести к дыхательной недостаточности.
Поражения костной ткани
Изменения в мышцах приводят к поражению костей скелета. Возникают искривления позвоночника (сколиоз, лордоз), сутулость (кифоз). А также искривляется грудная клетка и стопы. Кости истончаются и становятся хрупкими (диффузный остеопороз). Поражение костей ещё больше ограничивает способность больных к самостоятельному передвижению.
Нарушения работы сердца
 При мышечной дистрофии Дюшенна возникает кардиомиопатия. В патологический процесс вовлекается и сердечная мышца. Сердце увеличивается в размерах, при этом нарушаются его функции. Больные жалуются на аритмию и скачки артериального давления. Со временем может развиться сердечная недостаточность.
При мышечной дистрофии Дюшенна возникает кардиомиопатия. В патологический процесс вовлекается и сердечная мышца. Сердце увеличивается в размерах, при этом нарушаются его функции. Больные жалуются на аритмию и скачки артериального давления. Со временем может развиться сердечная недостаточность.
Гормональные нарушения
Миодистрофия Дюшенна часто приводит к развитию синдрома Кушинга. Возникает ожирение с жировыми отложениями в верхней части туловища. Ожирение сочетается с недостаточностью функции половых желёз. Иногда половые органы недоразвиты. Больные миодистрофией Дюшенна часто имеют невысокий рост и избыточный вес.
Интеллектуальные нарушения
Умственная отсталость наблюдается не во всех случаях. Примерно 30% больных миодистрофией Дюшенна имеют задержку умственного развития и низкий коэффициент интеллекта. Это связано с недостатком в головном мозге аподистрофина. Общий недостаток в организме белка дистрофина приводит к дефициту его особой формы - аподистрофина. Это вещество необходимо для нормальной деятельности головного мозга, его недостаток приводит к умственным нарушениям. Степень умственной отсталости при этом заболевании никак не связана с выраженностью мышечных нарушений. При тяжёлой мышечной слабости может быть нормальный интеллект.
Из-за невозможности нормально передвигаться такие дети часто бывают изолированы от общества сверстников, не могут посещать детские дошкольные и школьные учреждения. Это может усугублять умственные нарушения.
Диагностика миодистрофии Дюшенна
Для диагностики миодистрофии используют несколько видов исследования:

Лечение мышечной дистрофии Дюшенна
На сегодняшний день нет радикального метода лечения этой болезни. Заболевание считается неизлечимым и прогрессирующим. Оно неизбежно приводит к инвалидизации больного.
Возможна симптоматическая терапия для облегчения проявлений болезни .
Медикаментозные средства в лечении миодистрофии Дюшенна

Физиотерапия
Физиотерапевтические методы лечения помогают на время сохранить двигательную функцию пациента. Больным противопоказана полная обездвиженность и постельный режим, это приводит лишь к очень быстрому развитию болезни. Больным необходима умеренная активность.
- Полезны сеансы массажа и лечебной физкультуры.
- С целью нормализации функции дыхания показаны дыхательные упражнения.
Ортопедическая помощь
 Когда двигательные функции в результате болезни утрачиваются, приходится использовать ортопедические приспособления. При мышечных контрактурах применяют ортезы и специальные шины. Если образовалось серьёзное искривление позвоночника, то помогает использование корсетов. При полной невозможности самостоятельно передвигаться и стоять, применяют вертикализаторы и инвалидные коляски с электроприводом.
Когда двигательные функции в результате болезни утрачиваются, приходится использовать ортопедические приспособления. При мышечных контрактурах применяют ортезы и специальные шины. Если образовалось серьёзное искривление позвоночника, то помогает использование корсетов. При полной невозможности самостоятельно передвигаться и стоять, применяют вертикализаторы и инвалидные коляски с электроприводом.
Разработки новых методов лечения
Даже при использовании всех современных методов лечения не удаётся полностью победить мышечную дистрофию Дюшенна. Продолжительность жизни больных очень мала. Поэтому активно ведутся исследования новых методик лечения.
- Изучается возможность замены дефектного гена на здоровый ген.
- Исследуется терапия стволовыми клетками.
- Ведутся исследования по пересадке клеток, способных продуцировать белок дистрофин.
- Проводятся опыты на животных по замене белка дистрофина на атрофин.
- Изучается возможность замедления болезни путём исправления гена (пропуск экзонов).
Прогноз и профилактика болезни
На сегодняшний день прогноз мышечной дистрофии Дюшенна неблагоприятный. Болезнь прогрессирует и приводит к летальному исходу. Большинство больных не доживают до возраста 20- 30 лет. Смерть наступает из-за сердечной и дыхательной недостаточности и присоединившихся инфекций.
В предупреждении болезни большую роль играет пренатальная диагностика. Если в семье уже есть ребёнок, больной мышечной дистрофией Дюшенна, то в большинстве случаев это означает, что мать является носительницей дефектной X- хромосомы. А это значит, что существует риск рождения больного ребёнка и при последующих беременностях. Поэтому необходима консультация генетика и проведение пренатальных исследований (амниоцентеза, биопсии хориона). Эти методы могут точно определить наличие у плода генетического заболевания.
Прогрессирующая мышечная дистрофия Дюшена – это наследуемое заболевание, которое развивается в раннем возрасте. Характеризуется симметричной атрофией мышц, которая сочетаются с костно-суставными, сердечно-сосудистыми и психическими нарушениями.
Причины
Дистрофия Дюшена возникает по причине поражения гена, отвечающего за выработку дистрофина - белка, необходимого для нормального существования мышечной ткани человека. Это и приводит к развитию заболевания. Если женщина имеет дефектный ген, то она, как правило, не болеет, но передает его своим детям. Мальчики, которые получили этот ген, неизбежно заболевают дистрофией Дюшена. У девочек болезнь развивается очень редко, это может произойти в результате структурных аномалий хромосом.
Симптомы
Основные симптомы заболевания следующие:
- перерождение мышечной ткани;
- некроз некоторых волокон;
- постепенное замещение мышечной ткани жировой и соединительной тканями.
При синдроме Дюшена симптомы проявляются примерно к 18 месяцам жизни. Такие дети отстают в развитии. Первым признаком болезни может стать то, что ребенок к положенному времени не начинает ходить, а все попытки встать на ноги заканчиваются неудачно. Либо ребенок ходит вразвалку и часто падает, в отличие от других детей его возраста. Еще один характерный симптом болезни – попытки ребенка встать из сидячего положения, при этом он пытается поддерживать ноги руками.
Мышцы при прогрессирующей мышечной дистрофии Дюшена всегда атрофируются симметрично. В первую очередь поражаются крупные мышцы нижних конечностей и тазового пояса, далее – мышцы верхней части туловища, а затем – другие основные группы мышц.
Классический признак болезни – это псевдогипертрофия мышц на ногах, то есть икроножных. При этом происходит их ложное увеличение в результате отложения жира и разрастания соединительной ткани.
Псевдогипертрофия может проявляться на дельтовидных, ягодичных мышцах, а также мышцах живота и языка. При надавливании на мышцы больного можно ощутить, что они плотные и абсолютно безболезненные.
При подозрении на мышечную дистрофию проводится диагностика, включающая в себя ряд тестов на определение показателей жизненноважных функций. Доктор назначает проведение следующих исследований:

- Биохимический анализ крови. Здоровая мышечная ткань содержит в себе фермент креатинфосфокиназа. Если у больного присутствует мышечная дистрофия, то уровень этого энзима в крови очень высок.
- Мышечный тест. Посредством проведения электромиографии замеряется скорость проведения в мышцах нервных импульсов. Дети с мышечной дистрофией имеют результаты теста, резко отличающиеся от нормальных.
- Биопсия мышц. В этом случае проводится исследование образца мышечной ткани под микроскопом. При заболевании в ней обнаруживаются отложение жировой ткани и клеточные изменения.
- МРТ . Определяется церебральная атрофия.
- Генетический тест. Раннее обнаружение дефектного гена дает возможность начать лечение как можно раньше и тем самым и отдалить на максимальное время развитие патологий, сохраняя качество жизни больного.
Лечение
Сегодня в медицине нет способов, которые давали бы возможность предотвратить или притормозить прогрессирование мышечной дистрофии. Поэтому основная цель лечения – борьба с осложнениями, поддержание физической активности больного дистрофией и улучшение качества жизни в целом.
Своевременное лечение позволяет замедлить формирование сколиоза, а также позволяет больным двигаться. В некоторых случаях назначается ортопедическое вмешательство. Что касается лекарственной терапии, то часто назначается препарат преднизолон, который способствует замедлению прогрессирования болезни и увеличению мышечной массы.
Профилактика болезни заключается в генетическом консультировании родителей, которое необходимо проводить еще на этапе планирования беременности.
Прогноз
Течение мышечной дистрофии Дюшена - быстро прогрессирующее. Ко второму десятилетию жизни больного человека развиваются значительные двигательные расстройства, которые приводят к невозможности самостоятельного передвижения.
Для последней стадии характерно возникновение проблем с дыхательными мышцами, мышцами глотки и лица. Смерть зачастую наступает от острой сердечной и дыхательной недостаточности, чаще всего это происходит на втором либо третьем десятке жизни.
Ниже можно посмотреть мультфильм с русскоязычными субтитрами, в котором доступно рассказывается о мышечной дистрофии Дюшена: